[本站讯]2月25日,山东大学微生物技术国家重点实验室武大雷教授课题组和牛津大学Fraydoon Rastinejad教授课题组等合作在Nature Chemical Biology(《自然-化学生物学》IF:13.843)上在线发表了题为“Bidirectional modulation of HIF-2 activity through chemical ligands”的研究论文。本论文以山东大学为第一完成单位,武大雷教授和Rastinejad教授为共同通讯作者。

缺氧诱导因子(hypoxia-inducible factors, HIFs)是人体内一类重要的转录因子,可以调节与红细胞生成、血管新生以及无氧代谢相关的一系列基因转录,与癌症和贫血等多种疾病紧密相关。具有转录活性的HIF蛋白复合体由HIF-α和ARNT(即HIF-1β)两个亚基组成,而HIF-α蛋白有三种亚型,其中HIF-2α的过表达和活化是导致肾透明细胞癌的主要原因。目前直接作用于HIF-2α的小分子拮抗剂PT2385(及其类似物PT2977)已经进入治疗肾透明细胞癌的二期临床试验,通过阻断HIF-2α与二聚伙伴ARNT的结合发挥抑制作用,但其具体的分子机理尚不清楚。
另一方面,由于肾脏是产生促红细胞生成素(eythropoietin,EPO)的主要器官,慢性肾病病人常会因为EPO分泌不足而产生贫血症状。除了目前临床上广泛应用的人重组EPO蛋白,脯氨酸羟化酶(prolyl hydroxylase domain, PHD)的多种小分子抑制剂也对肾性贫血展现出良好治疗效果。体内HIF-2α的蛋白降解依赖于PHD对它的羟基化,因此这些抑制剂可以间接提高HIF-2α的蛋白水平和转录活性,增强下游基因EPO的表达。但HIF-2α是否可被化合物直接激活、作为治疗贫血和缺血性疾病的潜在新靶标还未见报道。
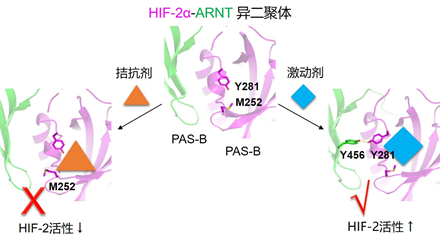
该研究通过体外化合物筛选首次发现了直接结合HIF-2α蛋白的小分子激动剂。跟拮抗剂相似,这类激动剂也结合在HIF-2α蛋白的同一个结构域中,但却导致二聚界面处不同的变构效应。利用蛋白-化合物共晶、氢氘交换质谱等技术手段,该研究揭示了拮抗剂和激动剂如何分别改变HIF-2α二聚界面处的不同氨基酸残基的构象,影响二聚体稳定性并双向调节其转录活性的分子机理(详见上图),为设计和发现活性更好的HIF-2α靶向小分子指明了方向,也初步证明HIF-2α蛋白有望作为治疗癌症(拮抗剂)和贫血性疾病(激动剂)的双面靶标。
该研究得到了山东大学齐鲁青年学者项目、微生物技术国家重点实验室和国家自然科学基金等的支持。
论文链接:https://www.nature.com/articles/s41589-019-0234-5