[本站讯]近日,前沿交叉科学青岛研究院李春霞教授团队在线粒体钙超载诱导细胞焦亡用于癌症免疫治疗研究方面取得新进展,相关研究成果以“Biodegradable Ca2+Nanomodulators Activate Pyroptosis through
Mitochondrial Ca2+Overload for Cancer Immunotherapy”为题发表在国际学术期刊Angew. Chem. Int. Ed.(化学一区,IF:16.823)。山东大学为该论文的第一完成单位。
细胞焦亡是一种独特的程序性细胞死亡方式,其特点通常表现为DNA碎裂、染色质凝结、细胞膨胀并鼓泡以及大量炎性分子和细胞内容物的泄漏。近年来,细胞焦亡作为一种新兴的、有效的癌症治疗策略而受到广泛关注,为肿瘤治疗提供了全新的方向和广阔的前景。尽管一些特定的离子、分子或者化疗药物被报道在一定条件下可以触发细胞焦亡,但是这些小分子依然面临着血液循环清除快、非特异性生物分布和大剂量药物引起的全身不良反应等问题。因此,构建和发现新型纳米焦亡诱导剂具有重要意义。
线粒体是细胞中必不可少的细胞器,对细胞的生存和增殖具有重要作用。正常情况下,线粒体中的游离Ca2+和结合钙处在一个动态平衡。一旦打破这个平衡之后,线粒体就会释放细胞色素C,激活Caspase-3蛋白,进而诱导细胞凋亡。为此,已经开发了许多钙离子纳米调节剂,并通过线粒体Ca2+超载来进行肿瘤治疗。然而Ca2+纳米调节剂介导的线粒体钙超载是否可以激活细胞焦亡仍有待探索。
近日,前沿交叉科学青岛研究院的李春霞教授和中国科学院长春应用化学研究所的林君研究员合作,通过制备姜黄素(CUR)负载的碳酸钙纳米材料作为生物可降解的Ca2+纳米调节剂(CaNMs),发现并证明了CaNMs可以通过多重作用诱导线粒体钙超载,激活gasdermin E(GSDME)蛋白,诱导肿瘤细胞焦亡,实现癌症免疫治疗。
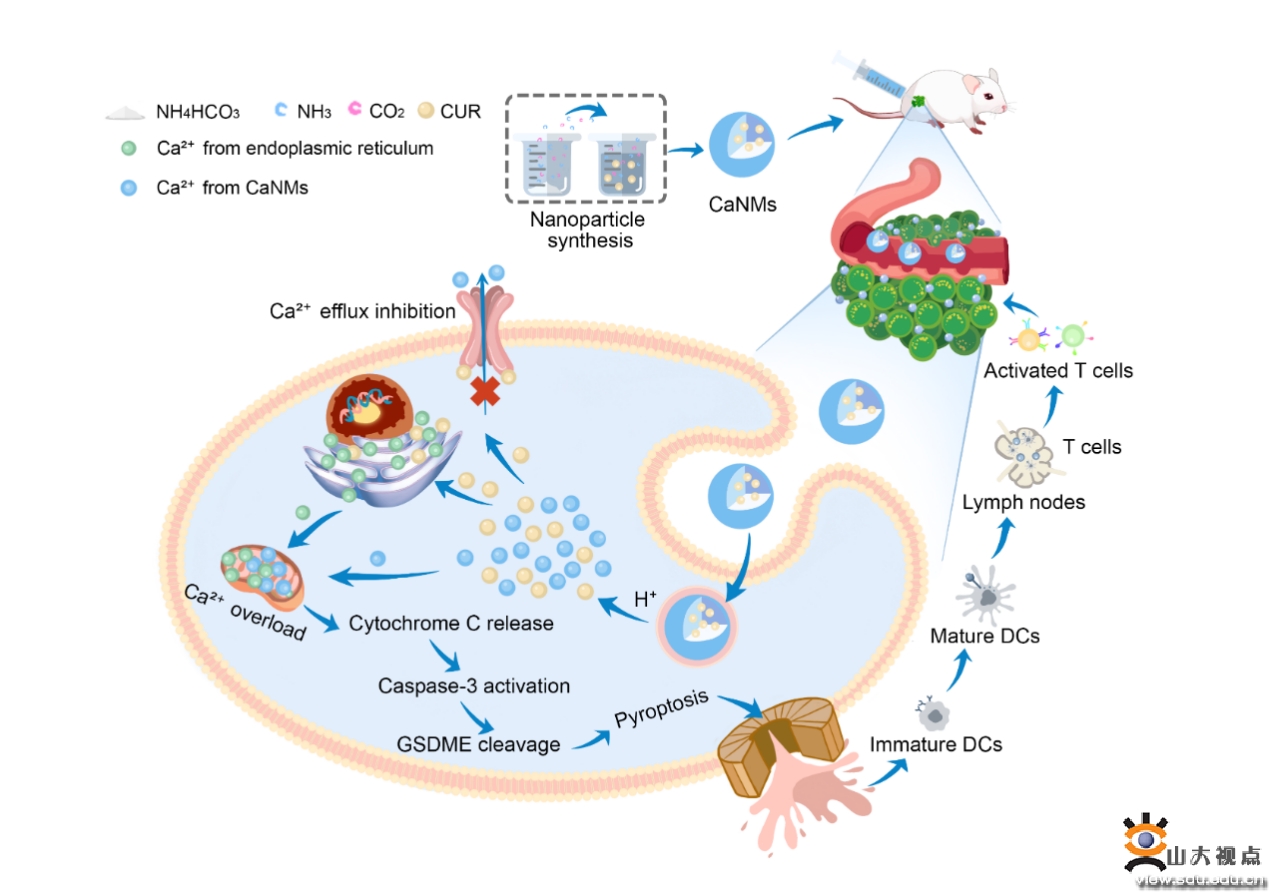
在肿瘤微酸条件下,CaNMs会同时释放Ca2+离子和CUR。CUR作为一种Ca2+离子调节剂,可以促进内质网中Ca2+释放到细胞质,并抑制Ca2+外排,从而实现多重线粒体钙超载。和单一的CUR以及CaCO3组相比,高浓度的CaNMs引起的钙离子激增会引起线粒体钙超载,会有效诱导线粒体活性氧产生,细胞色素C释放,Caspase-3和GSDME蛋白激活,从而实现细胞焦亡。而细胞焦亡伴随的细胞鼓泡和进一步的细胞裂解,会进一步诱导胞内大量的炎性分子和内容物释放,从而有效激活机体免疫反应,实现肿瘤的免疫治疗。
进一步体内抑瘤实验结果表明,该Ca2+纳米调节剂可以有效地抑制4T1肿瘤生长和肺部转移。总之,这项工作进一步拓展了Ca2+纳米调节剂的肿瘤治疗应用,并为焦亡介导的癌症治疗提供了新的策略和启示。文章第一作者是前沿交叉科学青岛研究院博士后郑盼和中科院长春应化所丁彬彬副研究员。上述工作得到了国家自然科学基金原创探索等项目的支持。
原文链接:https://doi.org/10.1002/anie.202204904