[本站讯]近日,微生物技术国家重点实验室李盛英教授团队在国际权威期刊Nature Synthesis发表了题为“Enzymatic synthesis of organoselenium compounds via C‒Se bond formation mediated by sulfur carrier proteins”的研究论文。该研究首次运用“元素工程”策略,将天然硫载体蛋白介导的有机硫化物生物合成系统改造为有机硒化物生物合成系统,成功拓展了该系统的催化元素谱,基于此实现了多种有机硒化物的创制与合成。论文的第一作者和通讯作者分别是微生物技术国家重点实验室张兴旺副教授和李盛英教授,山东大学是第一通讯单位。
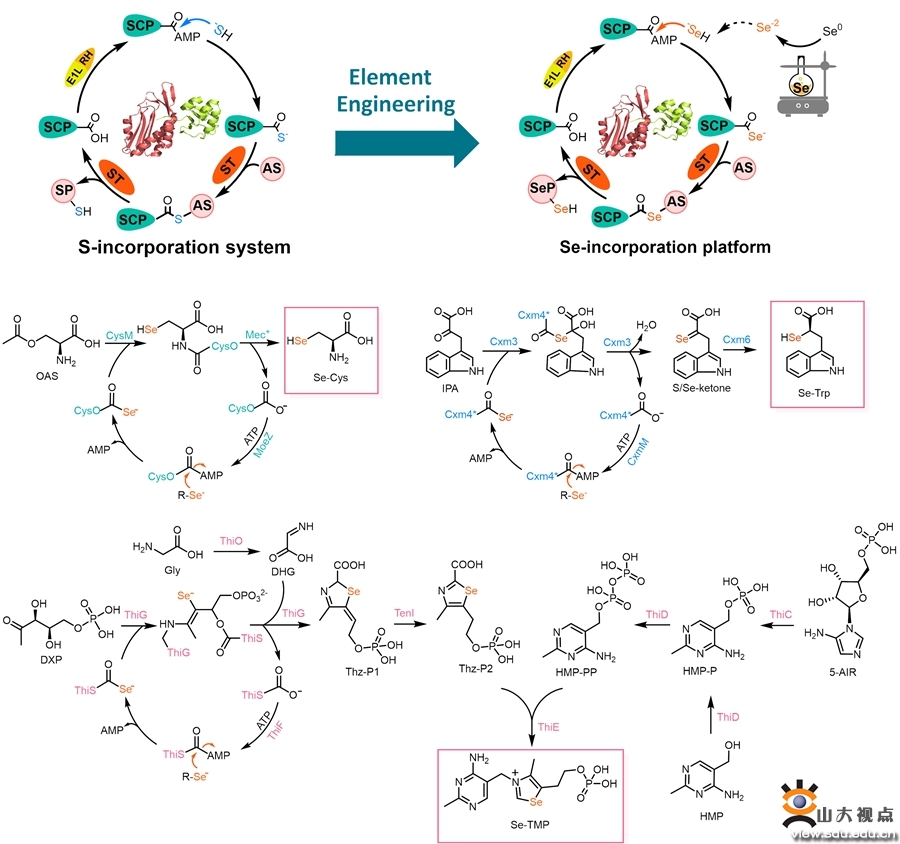
硫(S)和硒(Se)同属化学元素周期表第VI主族元素。与有机硫化物相比,有机硒化物在改善氧化还原性、优化药物构象、调节药物代谢、增加生物利用度、抵抗耐药性等方面具有重要优势,近年来逐渐成为药物研发领域的新兴热点分子类群。但是,天然有机硒化物数量稀少,复杂手性有机硒化物的化学合成具有很高的挑战性;与此同时,目前缺乏通过酶催化反应构筑C-Se键的有效手段;这些因素极大限制了有机硒化物的创制和深入研究。
自然界微生物中存在一类硫载体蛋白(sulfur carrier protein, SCP)介导的含硫天然产物生物合成系统,该系统以激活蛋白(activating Protein)和硫转移酶(sulfurtransferase)催化的两步亲核反应为底层化学基础来实现C-S键的选择性构筑。在本研究中,科研人员首次提出“元素工程”(Element engineering)概念,基于硫载体蛋白催化系统及其底层化学原理,以及硒和硫相近但又具有差异的物理化学性质,首先将硫载体蛋白(SCP)改造为硒载体蛋白(selenium carrier protein,SeCP),并进一步通过体外多酶级联催化,将“S”引入系统切换为“Se”引入系统,实现了硒代半胱氨酸、硒代维生素B1和硒代创新霉素衍生物的酶催化合成与创制。此外,在阐明相关蛋白杂泛性和系统适配性的基础上,研究人员对天然生物合成路径进行了重编程,设计了多条人工生物合成途径用以合成有机硒化物。
该研究利用“元素工程”策略将硫载体蛋白介导的硫引入系统切换为硒引入系统,成功实现了有机硒化物的酶法合成,为手性有机含硒分子的创制与合成提供了全新的生物催化方案,同时为运用生物催化系统创制更多含生命稀有元素甚至非生命元素化合物奠定了基础。本研究获得了国家重点研发计划、国家自然科学基金委杰出青年科学基金与重点项目、山东省重大基础研究项目等科研项目的资助。
