[本站讯]7月15日,Nature Protocols在线发表了山东大学微生物技术国家重点实验室王海龙教授课题组的研究论文“Seamless site-directed mutagenesis in complex cloned DNA sequences using the RedEx method”。王海龙教授为论文通讯作者,栾霁副研究员为论文第一作者。山东大学微生物技术国家重点实验室为第一完成单位和通讯作者单位。
模块化的聚酮合酶(PKS)、非核糖体肽合成酶(NRPS)以及它们的杂合体产生了多种在医药和农业领域具有重要价值的化合物,如抗生素红霉素和达托霉素,免疫抑制剂雷帕霉素和环孢菌素,杀虫剂阿维菌素和多杀菌素,以及抗癌药埃博霉素和博来霉素等。模块化PKS和NRPS蛋白由单个或多个模块组成,每个模块又由一组结构域组成。通过基因修饰对它们进行合理的工程改造,有望产生新型药物。然而,在多个模块中同时存在的相同结构域,导致编码多模块PKS和NRPS的基因簇中存在大量的DNA重复序列,阻碍了PKS和NRPS的工程改造。
为了解决这些难题,王海龙课题组于2020年开发了RedEx基因编辑技术,发表在Nucleic Acids Research(48(22), e130),通过结合Redαβ介导的线性-环状DNA同源重组、ccdB介导的反向筛选和核酸外切酶介导的体外DNA退火,在79kb的多模块聚酮合酶基因簇中无痕插入和缺失DNA,成功对绿色生物农药多杀菌素聚酮合酶基因进行改造,获得了杀虫活性更好的丁烯基多杀菌素以及乙基多杀菌素前体。
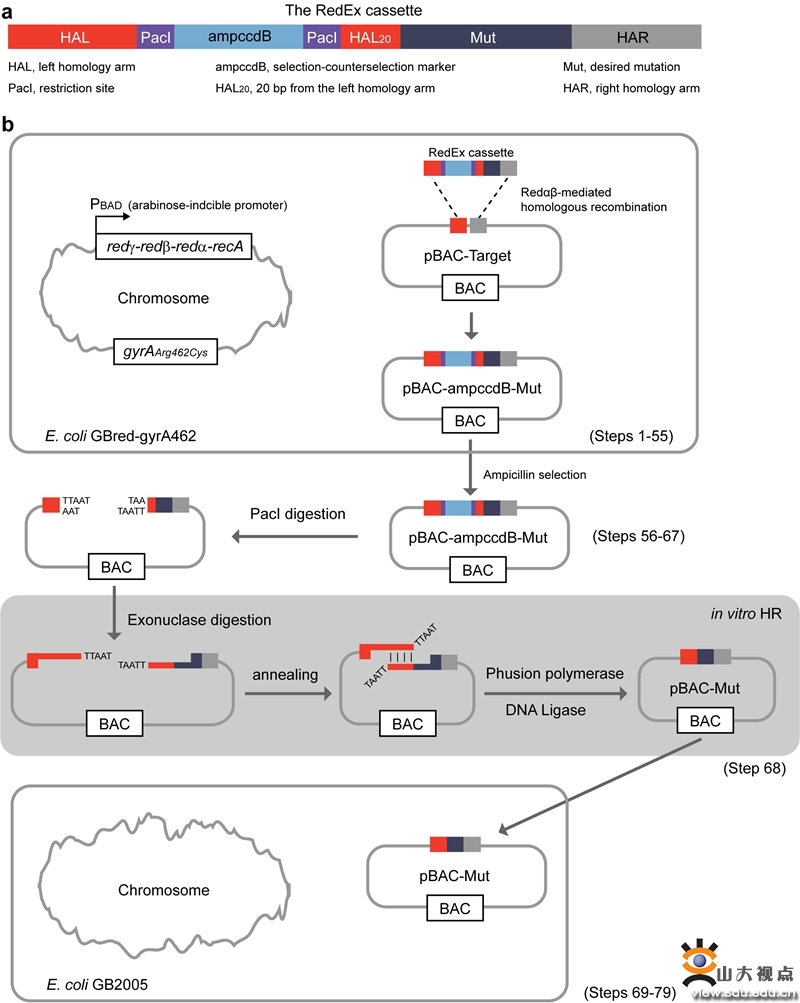
图1:RedEx技术无痕定点突变BAC策略概述
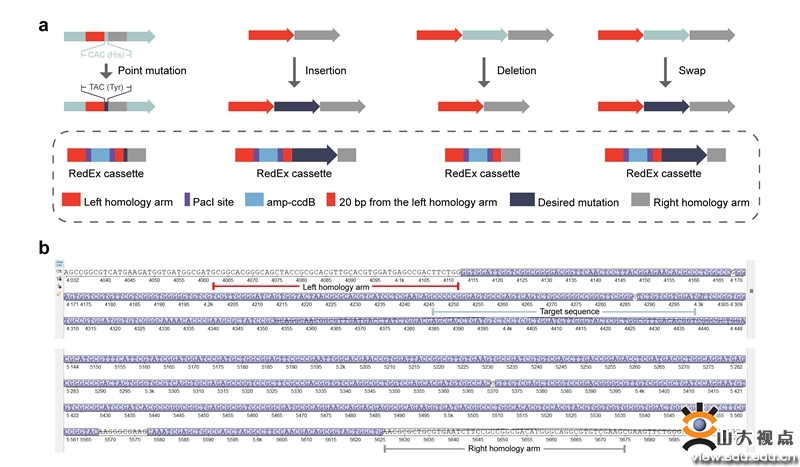
图2:使用RedEx进行点突变、插入、删除和替换的设计示例
最新发表在Nature Protocols的论文中,以BAC载体为例,详细描述了利用RedEx基因编辑技术对其进行无痕定点突变的过程。该过程可以在3周内完成,总体分为3步(图1):(i) 通过Redαβ同源重组将含有所需突变的RedEx基因盒插入到目标位点;(ii) 通过酶切去除BAC中的选择-反选择标记;(iii) 通过核酸外切酶介导的体外DNA退火对线性BAC进行环化。使用RedEx技术可以对高度重复、多模块基因簇进行点突变、插入、删除和替换等多种高效基因编辑(图2)。RedEx已经实现对质粒、黏粒和BAC等大DNA分子上的基因、基因簇或病毒基因组等的无痕突变,该论文将有助于研究人员掌握RedEx基因编辑技术,以辅助他们的研究。
本研究得到了山东大学张友明教授、符军教授和德国德累斯顿工业大学、山东大学A. Francis Stewart教授的支持,以及国家自然科学基金、山东省自然科学基金、国家重点研发计划、山东大学杰出中青年学者基金等项目的资助。
原文链接:https://www.nature.com/articles/s41596-024-01016-9
