[本站讯]近日,山东大学微生物技术改造全国重点实验室高超/马翠卿教授团队在Nature Communications上发表了题为“A genetically encoded biosensor for point-of-care and live-cell detection of D-2-hydroxyglutarate”的研究论文。实验室博士后刘一东为论文第一作者,高超教授为论文唯一通讯作者,山东大学微生物改造技术全国重点实验室为第一完成单位和通讯作者单位。

D-2-羟基戊二酸(D-2-HG)是微生物、植物、动物中普遍存在的内源性代谢物,在丝氨酸和磷酸吡哆醛合成、赖氨酸分解等生理过程中发挥重要作用。作为2-酮基戊二酸的结构类似物,D-2-HG异常积累抑制肿瘤细胞中2-酮基戊二酸依赖型双加氧酶,引发表观遗传改变;另一方面,外排至肿瘤微环境中的D-2-HG抑制免疫细胞的活性,促进肿瘤发生。其浓度升高可在相关基因突变的D-2-HG尿症、胶质瘤、急性髓性白血病等患者的体液或组织样品中检测到,D-2-HG的检测对疾病的诊疗有重要意义。然而,传统的D-2-HG检测方法(如质谱、色谱)耗时、昂贵,且无法实现活细胞内D-2-HG的动态监测,开发快速、灵敏、原位的检测工具成为科研和临床的迫切需求。
研究团队此前在反硝化无色杆菌(Achromobacterdenitrificans)NBRC 15125中鉴定到自然界中第一个D-2-HG特异性转录抑制调控因子DhdR,DhdR结合D-2-HG后从D-2-HG脱氢酶启动子区解离,启动D-2-HG脱氢酶表达,催化D-2-HG氧化为2-酮基戊二酸。进一步基于DhdR和AlphaScreen(Amplified luminescent proximity homogeneous assay)技术、FRET(Förster resonance energy transfer)技术开发了低成本、高通量的D-2-HG体外检测方法,相关工作分别发表于Nature Communications(2021, 12:7108)和Sensors and Actuators B: Chemical(2023,385:133681)。
D-2-HG脱氢酶是D-2-HG代谢的关键酶,已知存在两种D-2-HG脱氢酶:一种仅含GlcD结构域,广泛存在于植物、动物、微生物中;另一种含有GlcD和GlpC结构域,主要分布于肠杆菌中。目前文献报道的生物体均仅含一种D-2-HG脱氢酶,本研究发现恶臭假单胞菌(Pseudomonas putida)KT2440中同时含有以上两种D-2-HG脱氢酶,含有GlcD和GlpC结构域的PP4493表达受到D-2-HG的诱导,在P. putidaKT2440的D-2-HG代谢中起主要作用,仅含GlcD结构域的PP5154为组成型低表达,但也具有生理功能。P. putidaKT2440是唯一报道的具有两种D-2-HG脱氢酶的物种。PP4493下游基因PP4494编码LysR家族转录调控因子,经体内外生理生化分析确定PP4494为D-2-HG特异性转录激活调控因子,命名为HgcR。
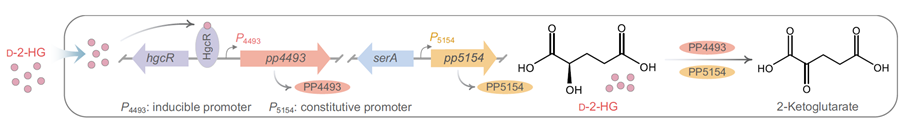
P. putidaKT2440中D-2-HG代谢和调控机制示意图
本研究进一步基于HgcR和环状重排黄色荧光蛋白(cpYFP)开发了高响应幅度、高荧光亮度、高特异性的D-2-HG生物传感器DHOR;并基于市售光电元件搭建了体积小、成本低的荧光检测设备,将依赖体积较大、成本较高的荧光酶标仪的实验室检测转变为便携式的床旁检测。利用该设备实现了模拟D-2-HG升高血清、尿液样本,以及小鼠肿瘤、人胶质瘤组织样本中D-2-HG的快速、精准检测。
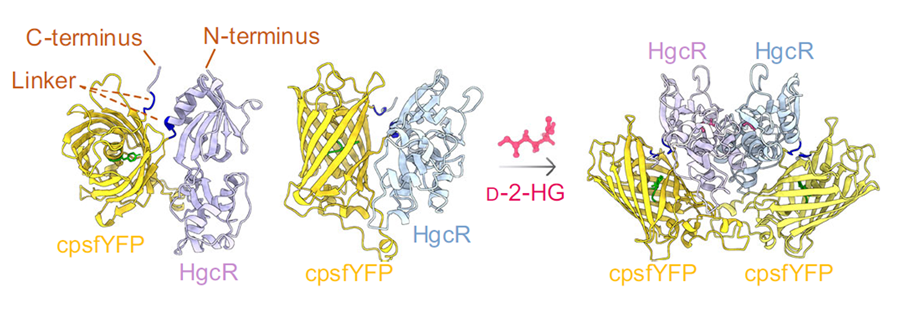
D-2-HG传感器DHOR结构示意图
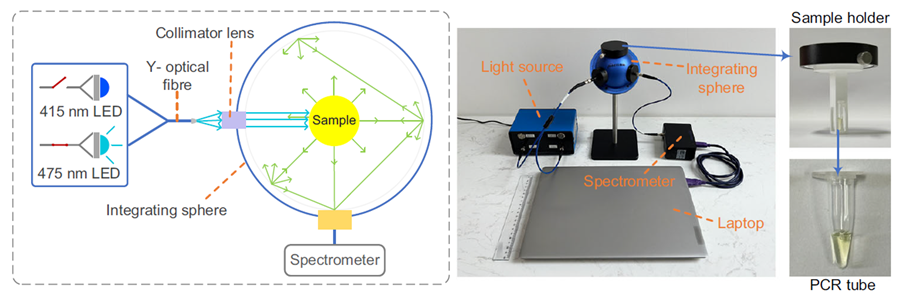
便携式D-2-HG荧光检测仪的原理和实物图
DHOR基因编码的特性以及适当的亲和力使其适宜于胞内D-2-HG的检测。本研究首先以大肠杆菌(Escherichia coli)模式菌株W3110为研究对象,应用DHOR验证了负责其D-2-HG合成和代谢的关键酶,鉴定了负责D-2-HG摄取和外排的转运蛋白。D-2-HG作为重要C5平台化合物戊二酸的结构类似物,其分子结构中特有的功能性羟基可改善聚酯、聚酰胺等聚合物的物理化学性质,在医药、化工等领域具有广阔的应用前景。本研究基于对大肠杆菌D-2-HG代谢和转运的认识,通过阻断D-2-HG降解和摄取、引入高效合成酶、加强外排等策略构建了D-2-HG高效生产菌株,实现了目前文献报道的最高D-2-HG产量和得率。
本研究进一步将DHOR应用于HEK293FT细胞的胞内D-2-HG原位、实时检测。DHOR可检测到由异柠檬酸脱氢酶IDH突变引起的胞内外D-2-HG积累,有潜力应用于IDH靶向抑制剂的高通量筛选。通过亚细胞定位的DHOR发现HEK293FT线粒体中的D-2-HG水平高于细胞质和细胞核,佐证了线粒体可能是D-2-HG的代谢中心。通过序列比对发现人类基因组中有E. coliD-2-HG外排蛋白的同源蛋白,SLC22A13。基于DHOR的胞内外检测发现SLC22A13在D-2-HG外排和摄取中均发挥作用。SLC22A13属于人类SLC22家族阴离子转运蛋白,本研究进一步对该家族的其他阴离子转运蛋白进行了研究,鉴定了另外5个具有D-2-HG双向转运功能的成员。相关结果可为肿瘤细胞与微环境的互作机制提供分子基础,以及为相关疾病的治疗提供潜在的靶标。
该研究工作得到了国家自然科学基金、中国博士后科学基金、山东省自然科学基金、青岛市博士后项目等资助,山东大学生命环境研究公共技术平台给予了大力支持。