[本站讯]近日,山东大学齐鲁医院普通外科肝胆外科李涛教授团队在肝胆研究领域取得新进展,相关研究成果分别发表于中科院1区TOP期刊Cancer Research(IF:16.6),Nature communications(IF:15.7),Metabolism(IF:11.9),Cellular & Molecular Biology Letters(IF:10.2),HEP Reports(IF:9.5),以及JCR 1区期刊International journal of surgery(IF:12.5)。
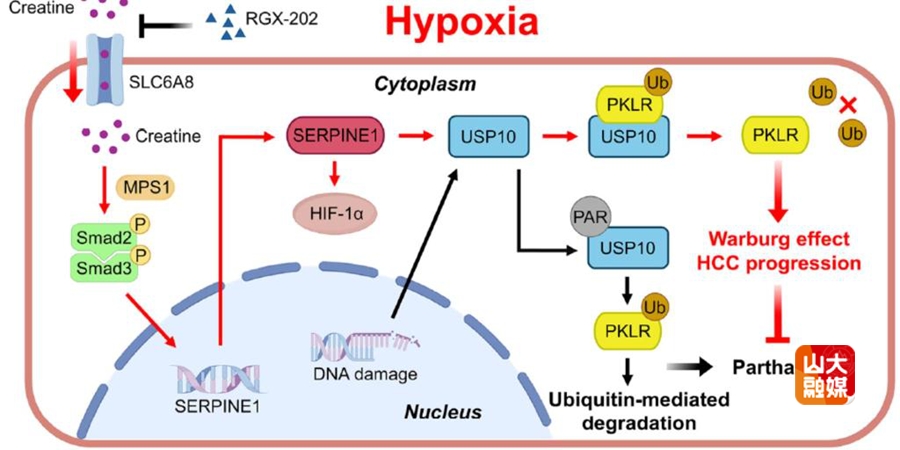
由DNA损伤驱动的PARP1依赖性细胞死亡(parthanatos)是组织稳态和肿瘤发生的关键调控机制,而缺氧是实体肿瘤的典型特征,会显著影响癌细胞的恶性表型。李涛教授团队发现在缺氧的肿瘤微环境中,肝癌细胞通过积累肌酸来逃避parthanatos,从而促进肝癌进展。尽管缺氧会导致DNA损伤,但肝癌细胞却能够抵抗由此引发的parthanatos,关键机制在于肌酸转运蛋白SLC6A8的活跃表达,促使细胞内肌酸蓄积,进而触发代谢重编程,帮助肝癌细胞在缺氧条件下存活并增强侵袭能力。深入分析发现,肌酸通过激活MPS1/Smad2/3信号通路,上调SERPINE1的表达,并与HIF-1α形成正反馈循环,最终稳定促癌蛋白PKLR,使肝癌细胞逃避死亡命运。研究团队还发现靶向SLC6A8的抑制剂RGX-202在临床前实验中表现出显著的抗肿瘤效果,无论是单药还是与靶向药仑伐替尼联用,均能有效抑制肝癌生长,这一发现揭示了靶向肌酸代谢通路的治疗策略,为肝癌精准治疗开辟了新的研究方向。研究成果“Hypoxia-Induced Creatine Uptake Reprograms Metabolism to Antagonize PARP1-Mediated Cell Death and Facilitate Tumor Progression in Hepatocellular Carcinoma”发表于Cancer Research。博士研究生李睿哲和博士后潘国强为共同第一作者,肝胆外科李涛教授和董兆如教授为共同通讯作者。
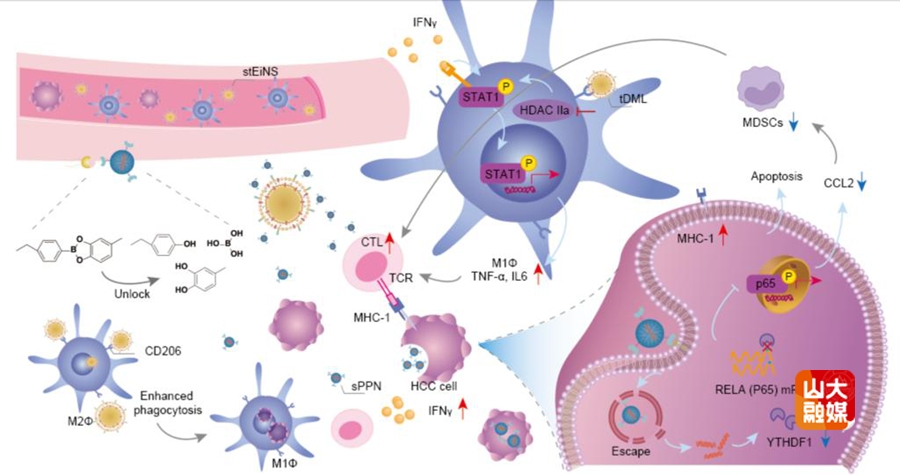
肝癌是中国第二位的癌症死亡原因,5年生存率仅为14%。以免疫治疗为主的系统治疗是晚期肝癌的一线治疗方案,但其疗效仍不理想,肿瘤免疫微环境(TIME)中的表观遗传学改变是其重要原因之一。在TIME中,肿瘤细胞利用表观遗传机制降低免疫细胞识别和免疫原性,从而阻止免疫介导的细胞死亡。因此,通过表观遗传治疗进行调控是临床治疗肝癌的潜在策略。李涛教授团队与姜新义教授团队合作,构建了一种表观免疫纳米卫星系统(stEiNS),通过协同递送靶向YTHDF1的siRNA和组蛋白去乙酰化酶IIa抑制剂TMP195,实现对肝癌细胞和M2型巨噬细胞的双重表观重编程以增强免疫治疗效果。stEiNS通过敲低肝癌细胞的YTHDF1表达并诱导巨噬细胞向抗肿瘤表型转化,显著增强了巨噬细胞—细胞毒性T淋巴细胞与肝癌细胞的相互作用,引发强效肿瘤杀伤免疫,实现高效肿瘤清除。本研究构建的双靶向stEiNS系统为肝癌及多种恶性肿瘤提供了具有临床应用潜力的表观免疫治疗新策略,研究成果“Epigenetic modulation with nanosatellite triggers tumoricidal immunity for hepatocellular carcinoma treatment”发表于Nature Communications。博士后曲颖及山东大学药学院陈晨为共同第一作者,肝胆外科李涛教授和药学院姜新义教授为共同通讯作者。
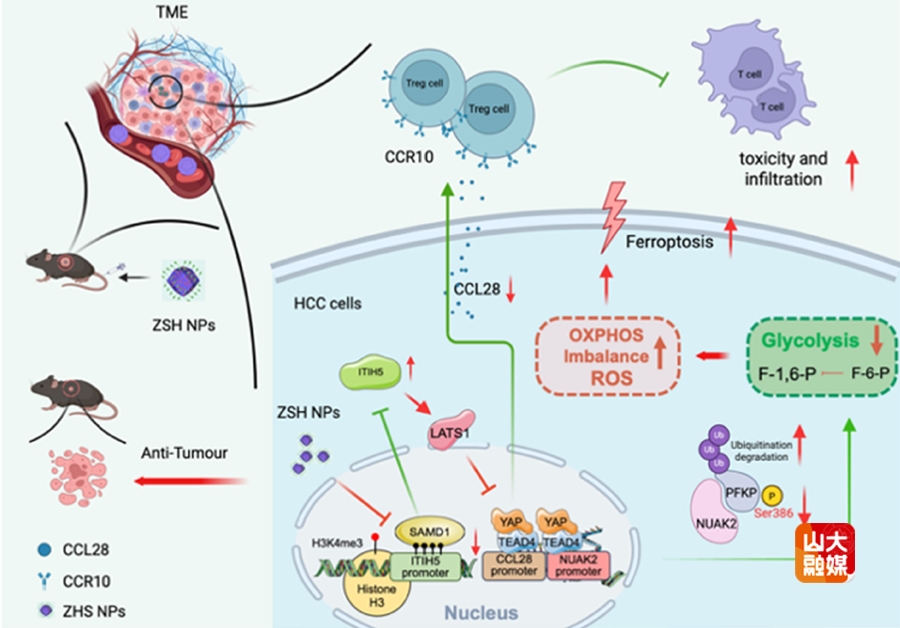
肿瘤微环境的免疫抑制和代谢重编程是制约肝癌免疫治疗效进一步提高的关键因素。李涛教授团队发现肝癌中高表达的SAMD1蛋白是影响治疗效果的关键分子之一。SAMD1既通过调控NUAK2/PFKP通路维持糖酵解代谢,又通过CCL28介导的Treg细胞招募营造免疫抑制环境。该团队首次揭示了通过靶向SAMD1调控NUAK2/Hippo通路抑制PFKP Ser386磷酸化,促进糖代谢从糖酵解转向氧化磷酸化,从而增强铁死亡敏感性和减少Treg细胞浸润的机制。团队利用ATP/酸响应性纳米颗粒递送siRNA,证实靶向SAMD1可通过双重调控代谢和免疫微环境显著提高靶向及免疫联合治疗的抗肿瘤效果,有望为晚期肝癌患者提供更优治疗选择。研究成果“Targeting SAMD1 enhances the effect of anti-PD-1 plus lenvatinib therapy in hepatocellular carcinoma by increasing ferroptosis sensitivity and immune response”发表于Metabolism。肝胆外科博士研究生潘国强、博士后阎钰钏和博士研究生李睿哲为共同第一作者,肝胆外科李涛教授和董兆如教授为共同通讯作者。
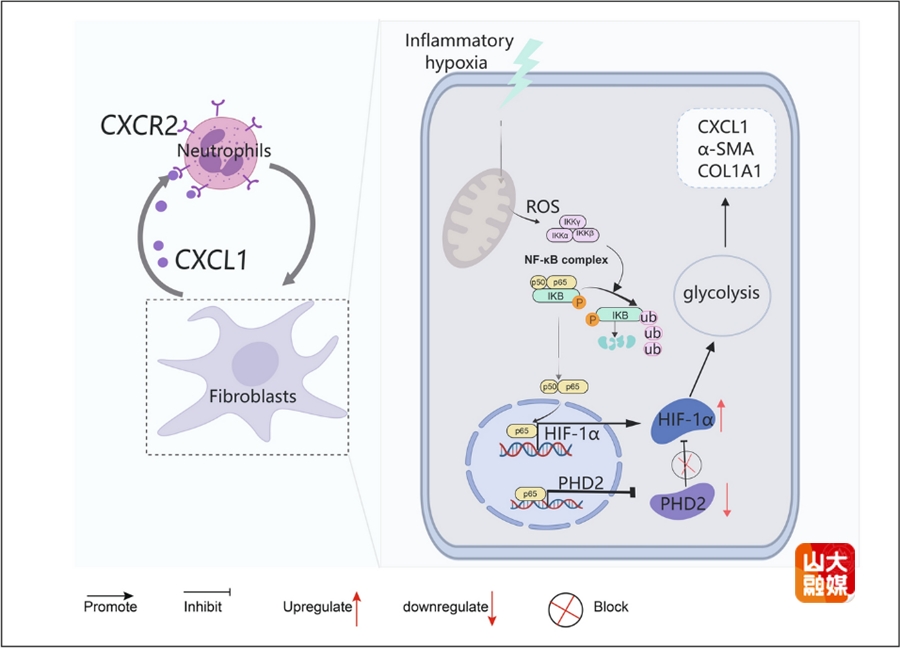
急性胰腺炎(AP)是临床上最常见的急腹症之一,胆结石导致的胆源性胰腺炎是AP的最主要类型。免疫细胞介导的机体过度炎症反应是AP发生进展的主要机制,而中性粒细胞募集是AP发展的关键因素。李涛教授团队和哈医大一附院合作,聚焦于AP中性粒细胞过度浸润的免疫驱动机制,揭示了成纤维细胞激活在中性粒细胞募集中的关键作用,发现胰腺组织中的中性粒细胞和成纤维细胞在AP中表现出显著的异质性,阐明了缺氧环境下NF-κB-HIF-1α信号通路通过糖酵解促进成纤维细胞分泌CXCL1,从而趋化中性粒细胞浸润加重AP的分子机制。而阻断该信号通路可显著改善AP的炎症反应,为临床治疗AP提供了潜在靶点。研究成果“Immunodynamic axis of fibroblast-driven neutrophil infiltration in acute pancreatitis: NF-κB-HIF-1α-CXCL1”发表于Cellular & Molecular Biology Letters。肝胆外科博士后王强、博士研究生张晓和硕士研究生韩承泷为共同第一作者,肝胆外科李涛教授和哈医大一附院王立一教授为共同通讯作者。
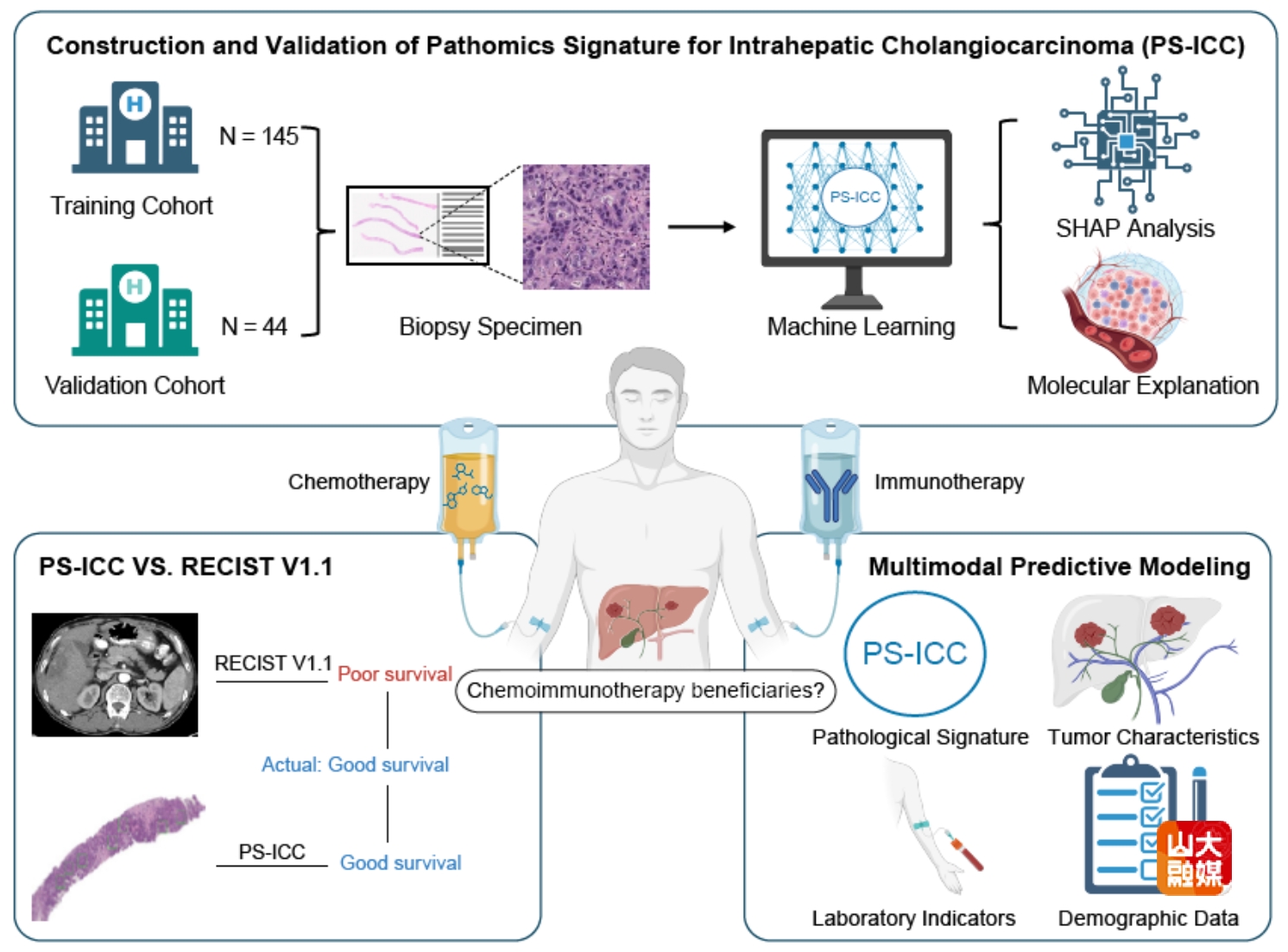
肝内胆管癌(ICC)是起源于肝内胆管上皮的高度侵袭性肝脏恶性肿瘤,晚期患者的5年生存率低于10%。化疗联合免疫治疗已被纳入临床指南,成为晚期ICC的一线治疗选择。但临床中仍有约40%患者存在原发耐药,如何在治疗前精准预测患者对化疗免疫联合治疗的应答一直是临床面临的挑战。李涛教授团队近日成功开发并验证了一种整合病理组学的多模态预测模型(PS-ICC),为不可切除ICC患者的化疗免疫治疗疗效评估提供了全新工具。该团队基于一线化疗免疫联合治疗患者的术前活检样本,通过人工智能机器学习从H&E染色数字病理图像中提取深层特征构建了PS-ICC评分系统,该模型能显著区分治疗获益人群,对患者总生存期具有显著预测价值,较传统RECIST 1.1评估标准更早、更准确地预测患者生存获益。进一步研究发现,PS-ICC低分患者的肿瘤微环境呈现显著异质性:M0型巨噬细胞浸润不足,PD-L1/PD-1免疫检查点通路活性降低,从机制上证实了该模型的生物学合理性。研究成果“Pathomics-Integrated Multimodal Model Evaluate Chemoimmunotherapy Efficacy in Unresectable Intrahepatic Cholangiocarcinoma”发表于JHEP Reports。肝胆外科硕士研究生曹启航和李涵为共同第一作者,肝胆外科李涛教授和王东旭副教授为共同通讯作者。
靶向药物联合免疫检查点抑制剂的系统治疗方案是中晚期肝癌的一线治疗方案,但是疗效仍然有限。李涛教授团队通过对17项国际临床试验中的3070名晚期肝癌患者的临床数据进行深入分析,证实肝动脉灌注化疗(HAIC)联合靶免系统治疗方案可显著提升晚期肝癌患者的生存获益。该研究显示,与单纯靶免系统治疗相比,HAIC联合靶免系统治疗组肝癌患者中位总生存期提升近1倍,疾病控制率达到86.9%,疾病进展风险降低46%,肿瘤客观缓解率达到单纯靶免系统治疗组的2.2倍。亚组分析显示合并门静脉癌栓的肝癌患者生存获益尤为显著。HAIC联合靶免系统治疗可突破现有治疗瓶颈,有望重塑晚期肝癌治疗格局。研究成果“Systemic therapy plus HAIC versus systemic therapy for hepatocellular carcinoma: a systematic review and meta-analysis”发表于International journal of surgery。肝胆外科硕士研究生鲁东海和李涵为共同第一作者,肝胆外科李涛教授和王东旭副教授为共同通讯作者。
上述研究受到山东省泰山学者特聘专家、山东大学杰出中青年学者、国家自然科学基金、山东省自然科学基金重大基础研究及济南市高校院所创新团队等项目资助。