[本站讯]9月11日,生命科学学院孙佳琦教授团队与加拿大麦吉尔大学郑环泉教授团队合作,在Developmental Cell上发表了题为“Biomolecular condensates of ATG18 reshape ER for autophagy in plants”的研究论文。该研究系统揭示了ATG18通过液-液相分离形成生物分子凝聚体,进而重塑内质网并调控植物自噬小体形成的新机制。

自噬是细胞内物质降解与循环的关键过程,在植物应答环境胁迫中具有重要作用。孙佳琦团队前期研究发现,RABC1可招募ATG18a至内质网并促进自噬小体扩张,然而ATG18a如何精确调控自噬小体形成的机制尚不明确。近年来,生物分子凝聚体作为无膜细胞器在细胞调控中的功能日益受到关注,但其在膜动态重塑与自噬调控中的具体机制仍有待深入解析。
本研究通过结构预测与功能实验发现,ATG18a蛋白含有内在无序区域,能够在盐胁迫等条件下发生液-液相分离,形成动态的生物分子凝聚体。荧光恢复实验和活体成像分析表明,ATG18a凝聚体呈现高度动态、中等流动性和低流动性三种状态,分别对应自噬小体形成的起始、扩张和成熟阶段。遗传证据进一步显示,缺失该无序区域的突变体无法发生相分离,亦不能恢复自噬缺陷表型,表明相分离对ATG18a功能具有必要性。
研究还揭示了RABC1–RHD3–ATG18a三元复合体的协同调控机制。内质网塑形蛋白RHD3作为关键组分,与RABC1和ATG18a共同调控自噬过程。尤为重要的是,ATG18a凝聚体通过“润湿”作用驱动内质网从球形液滴经新月形最终形成稳定的环状结构,同时引导周围内质网膜重塑为互补的环状,为自噬小体形成提供了其专用的膜平台。该研究首次建立了相分离凝聚体调控内质网膜重塑的工作模型,拓展了生物分子凝聚体在膜生物学中的功能认知。
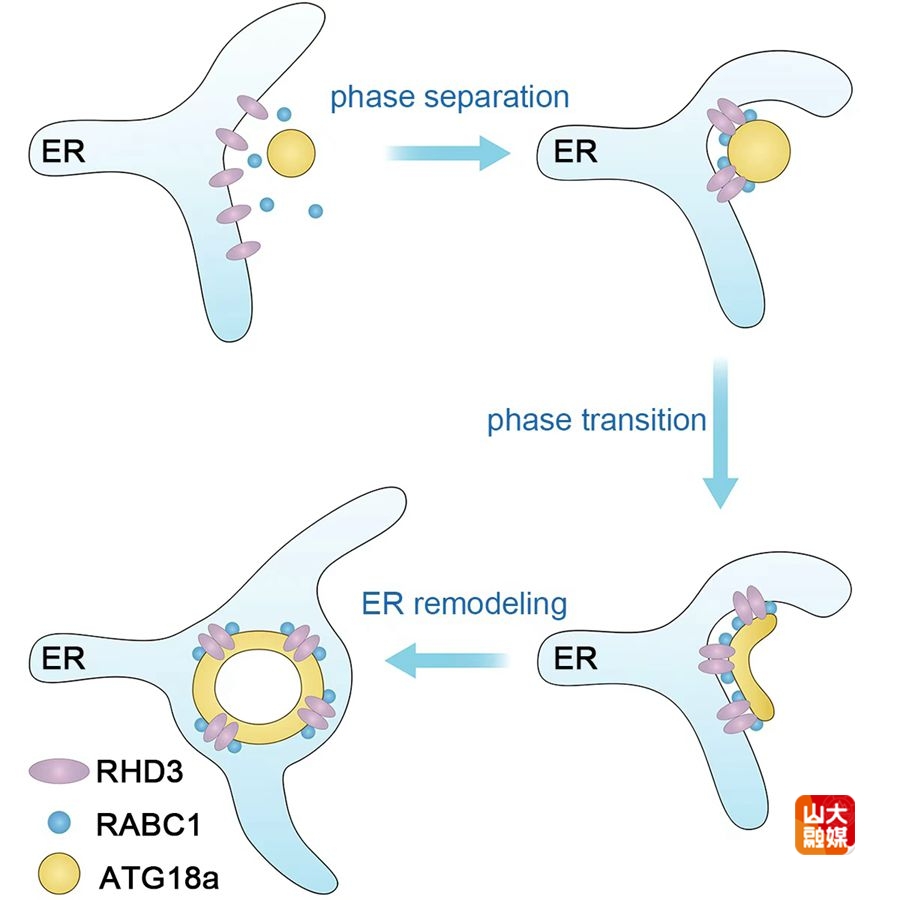
ATG18a凝聚体通过RABC1-RHD3-ATG18a途径重塑内质网的工作模型
孙佳琦教授,郑环泉教授为本文共同通讯作者。山东大学生命科学学院博士后邵阳为论文第一作者。团队成员汪嵩洋、史本惠、李保磊、梁丽等,以及已毕业研究生李训政、冯舒清在该研究中作出重要贡献。浙江大学教授罗自生、上海交通大学教授徐艳群也参与了合作研究。本研究受到国家自然科学基金、山东省泰山青年学者计划、山东省高等学校青年创新团队发展计划及植物发育与环境适应生物学教育部重点实验室开放基金等资助。
孙佳琦教授团队长期致力于植物自噬分子机制、膜运输调控和植物抗逆生物学研究,主持包括国家自然科学基金、泰山青年学者、山东省高等学校青年创新团队发展计划等多项国家级和省部级课题,先后在Developmental Cell(2)、Nature Communications、Plant Cell、Molecular Plant等国际主流学术期刊发表多篇高水平论文,在植物细胞生物学领域具有重要影响力,多项研究成果为理解植物细胞膜生物学和自噬调控机制提供了重要理论基础。