[本站讯]近日,微生物改造技术全国重点实验室佘群新教授团队在国际期刊Nucleic Acids Research发表题为“Substrate-induced remodeling of protein disordered loops activates Csm DNases”的研究论文,首次清晰地揭示了细菌III-A型CRISPR系统(Csm系统)的DNase激活机制。团队助理研究员于振霄、博士后王方为论文的共同第一作者,佘群新教授、于振霄为共同通讯作者,山东大学微生物改造技术全国重点实验室为第一完成单位和唯一通讯作者单位。

CRISPR-Cas(Clustered Regularly Interspaced Short Palindromic Repeat, CRISPR-associated)系统是原核生物中广泛存在的适应性免疫系统,通过引导RNA介导抗病毒活性。其中,III型是最古老CRISPR系统,其多蛋白效应子被激活后同时具备DNase活性和环寡聚腺苷酸(cOA)合成活性,后者通过进一步激活CRISPR信号通路来介导流产感染。对该系统核酸蛋白复合物的结构生物学研究主要集中在III-A Csm亚型,但是,对多种Csm核酸蛋白复合物的研究仅揭示了其cOA的合成及其调控机制,而未能鉴别其DNase活性位点在激活、非激活状态下的显著构象差异,也未能捕捉到其结合DNA底物的构象。因此,DNase的调控与催化机制长期以来一直是III型CRISPR研究领域尚未解决的难题,阻碍了对其介导的免疫功能及其与cOA信号通路之间的协同作用的进一步研究。
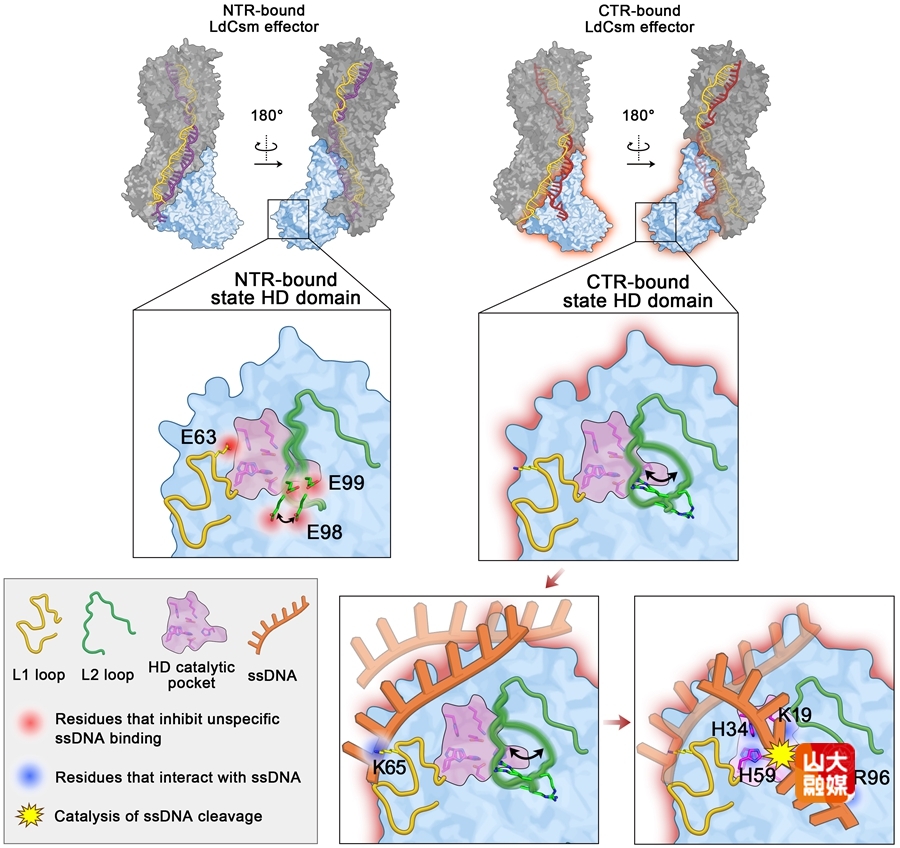
为解决这一难题,研究团队以保加利亚乳杆菌的III-A型Csm(LdCsm)系统为研究对象,首次使用AlphaFold 3(AF3)预测和实验验证相结合的策略对其DNase活性的调控与催化机制进行了探究。首先,AF3结构预测显示其DNase活性口袋两侧存在两段不规则蛋白loop—L1和L2,可能发挥重要作用。进化树分析显示这些loop在不同Csm系统中广泛存在。在此基础上,通过遗传学和生化实验,证明了L1、L2以及DNase活性口袋对于维持DNase活性的重要性,揭示了L1、L2的电荷水平影响DNase活性的规律。进一步地,分析了L1、L2以及DNase活性口袋对DNA底物结合能力的影响,证明LdCsm系统通过L2的重构调节DNA底物结合能力,进而调控DNase活性。该研究首次清晰阐释了III-A型Csm系统由L1、L2和DNase活性口袋共同介导的DNase调控分子机制,不仅为相关结构生物学研究的进一步突破提供了线索,还有利于指导对基于Csm系统DNase活性的RNA诊断工具的改造和优化。
该研究获得了国家重点研发计划、国家自然科学基金和山东省自然科学基金等资助。研究团队此前已在Ⅲ型CRISPR系统领域取得多项重要成果(见综述Yu et al.,Sci China Life Sci, 2021),对保加利亚乳杆菌的III-A型CRISPR系统的研究发现该系统仅具备DNase活性,揭示了III-A型CRISPR系统DNase的免疫机制(Cell Discov, 2020;Nucleic Acids Res, 2021;Eng Microbiol, 2023);LdCsm的应用研究建立了基于该系统的RNA检测技术并通过与石墨烯场效应晶体管(GFET)传感器的联用开发了对癌症相关小RNA进行诊断的生物传感器(Int J Mol Sci, 2023;Nanomicro Lett, 2025)。此外,本团队还于今年7月和9月在同一期刊上发表首例CRISPR信号通路CARF-PIN效应子的鉴定及其功能和作用机制解析和首例古菌DNA损伤应答网络的磷酸化调控等学术论文。