[本站讯]近日,药学院张娜、刘永军教授团队在定位控释巨噬细胞药物递送系统增强肿瘤疗效方面取得新进展,并在“中国科技期刊卓越行动计划”入选期刊Acta Pharmaceutica Sinica B杂志上发表了题为"Localized light-triggered release macrophage cytopharmaceuticals containingO-nitrobenzyl group for enhanced solid tumor cell-chemotherapy"的研究性论文(中科院一区TOP,影响因子:14.7),刘永军教授为通讯作者,2023级博士研究生刘金虎和2022届硕士毕业生杨晗为第一作者,药学院为第一作者单位和唯一通讯作者单位。张娜教授和课题组其他成员为本研究提供了重要指导和帮助。
基于活细胞的药物递送系统是靶向递药领域近年来的研究热点。该药物递送系统是由游离药物或纳米药物在体外装载于活细胞表面或内部构成,具有良好生物相容性、天然靶向性、低免疫原性和形态灵活等优势。红细胞、免疫细胞(T细胞、巨噬细胞、中性粒细胞、自然杀伤细胞等)和干细胞等天然细胞都可被用作活细胞药物的载体细胞。与其他细胞相比,巨噬细胞具有肿瘤趋向、吞噬杀伤、抗原递呈和分泌细胞因子调节免疫微环境的能力,是活细胞药物中极具发展潜力的载体细胞类型。然而,在保持巨噬细胞活性和发挥其免疫治疗作用的同时,如何在疾病部位控制药物释放仍然是一个挑战。
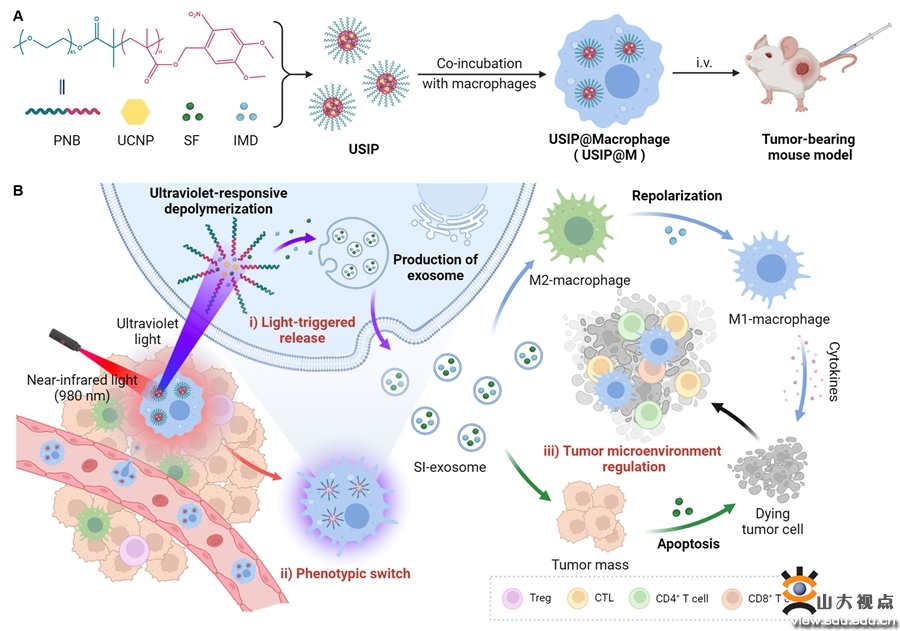
图1光定位控释巨噬细胞药物递送系统的制备流程和起效机制示意图
该论文合成了具有紫外光响应能力的含有邻硝基苄基的两亲性嵌段共聚物(PNB),并共载多靶点酪氨酸激酶抑制剂索拉非尼、巨噬细胞极化药物IMD-0354和上转化纳米颗粒,制得纳米药物(USIP),进而与巨噬细胞体外共孵育,得到光定位控释巨噬细胞药物递送系统(USIP@M),该系统利用巨噬细胞的肿瘤趋向性实现药物的靶向递送。上转化纳米颗粒能够将组织穿透性强、安全性良好的近红外光转化为紫外光,促进两亲性嵌段共聚物的紫外光响应性解聚,并诱导巨噬细胞外泌体产生,加速装载药物的外排,且维持巨噬细胞自身活性。IMD-0354能够同时极化载体巨噬细胞和肿瘤相关巨噬细胞,发挥M1型巨噬细胞的抗肿瘤作用,增强T细胞介导的免疫反应,缓解肿瘤微环境的免疫抑制状态。联合使用索拉非尼,能够协同化疗杀伤,有效缓解肿瘤负荷。综上所述,基于光定位控释策略,本论文成功构建一种新型巨噬细胞药物递送系统,该系统既能定位控制药物释放,又能保持巨噬细胞活性,发挥其免疫治疗作用,有效治疗实体肿瘤。
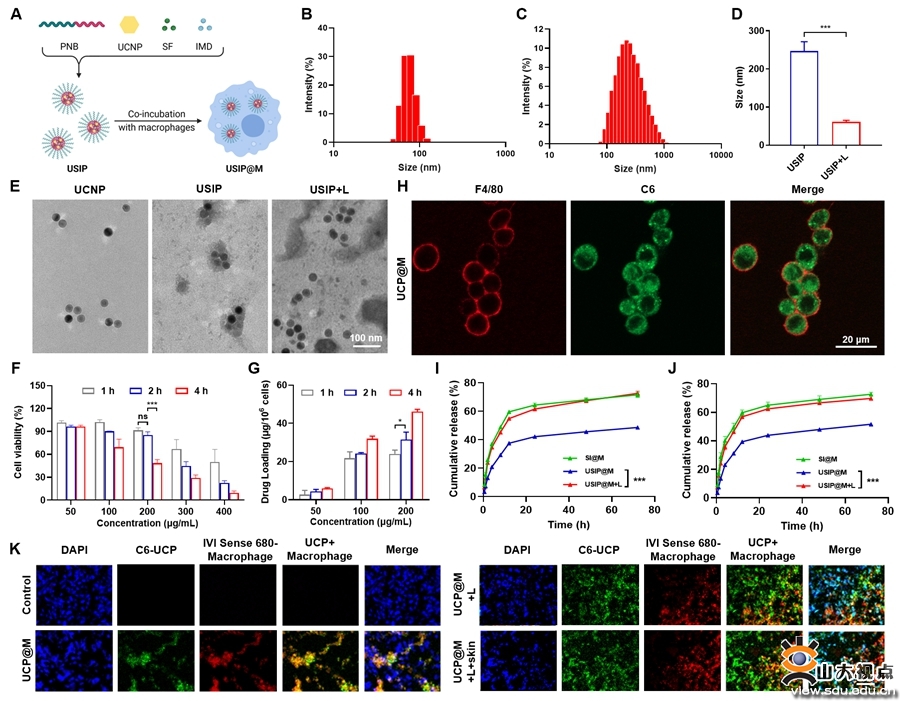
图2光定位控释巨噬细胞药物递送系统装载的纳米药物具有光敏解聚特征,能够实现光响应药物释放
经静脉注射后,USIP@M依赖CCL2/CCR2信号轴主动靶向肿瘤部位,显著增强药物的肿瘤蓄积和深层渗透。经外部光源照射后,近红外光在肿瘤部位被转换为紫外光,纳米药物结构裂解,同时诱导外泌体产生,加速药物外排。通过USIP@M药物释放曲线和肿瘤组织切片实验,进一步证实USIP@M的光响应药物释放性能。由于药物以外泌体形式释放,显著增加了肿瘤细胞对药物的摄取,载体巨噬细胞和肿瘤相关巨噬细胞极化为具有抗肿瘤作用的M1型。联合索拉非尼的化疗作用,USIP@M具有更加显著的抗肿瘤作用。研究结果表明,USIP@M释放的药物能够有效促进肿瘤细胞凋亡,抑制肿瘤细胞增殖,在H22荷瘤小鼠模型和B16F10荷瘤小鼠模型中均显示了良好的抗肿瘤效果。该论文为基于活巨噬细胞的药物递送系统研究提供了新的思路。
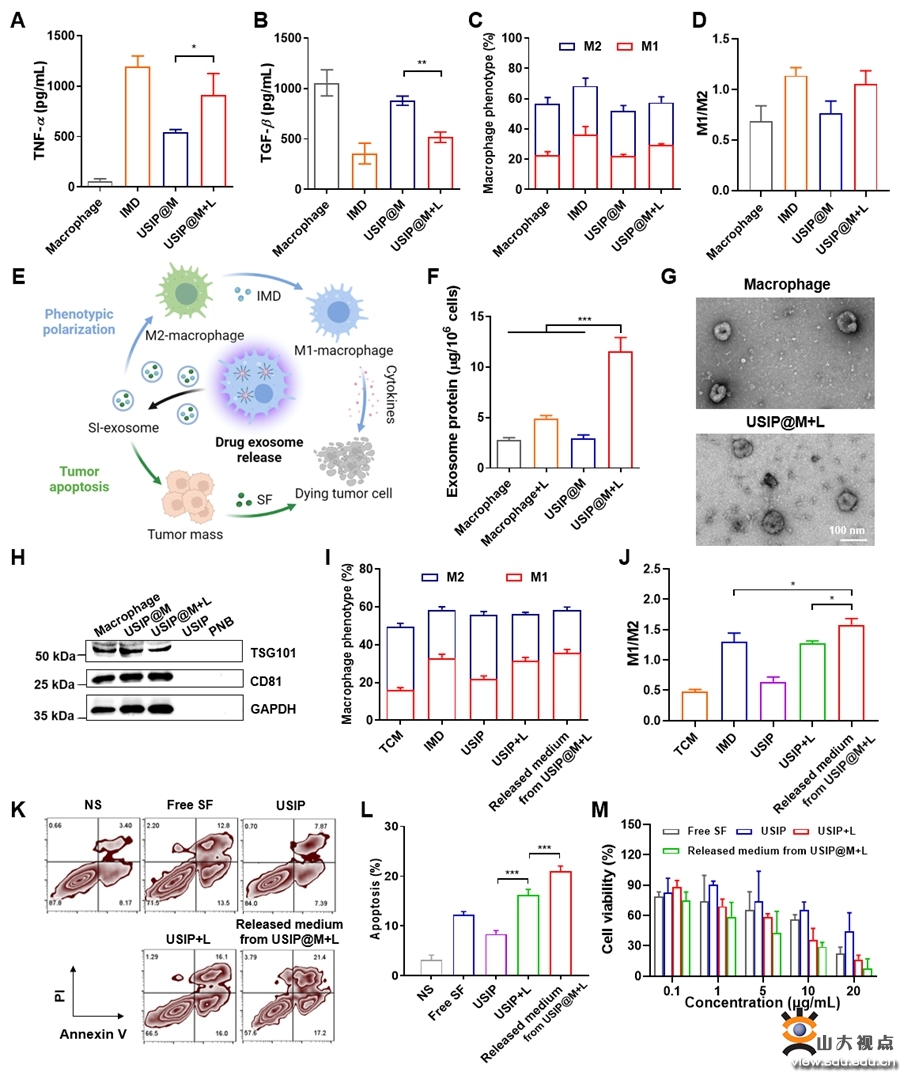
图3由近红外光转换而来的紫外光能够促进巨噬细胞药物递送系统释放具有治疗作用的药物外泌体
近年来,张娜、刘永军教授团队在肿瘤免疫联合治疗方向取得了一系列研究成果,先后开发了基于极化巨噬细胞的药物递送系统(Nanomicro Lett, 2020, 13, 6),重塑肿瘤免疫微环境的纳米笼(ACS Nano, 2022, 16, 4263-4277),双转换原位自组装疫苗(Chem Eng J, 2023, 454, 140190),自体肿瘤疫苗(Biomaterials, 2023, 297, 122104),重塑肿瘤-淋巴结免疫微环境的纳米诱导剂(Nat Commun, 2023, 14, 2248),纳米编辑巨噬细胞制剂(Nat Commun, 2024, 15, 8203)等新型药物递送系统。上述研究工作得到了国家自然科学基金,山东省优秀青年基金和山东大学齐鲁青年学者项目的大力支持。
