[本站讯]近日,山东大学齐鲁医院络病理论创新转化全国重点实验室在心血管重构的机制研究中取得系列新进展,在Nature子刊Nature Communications(中科院1区,最新影响因子16.6)、国际期刊Advanced science(中科院1区,最新影响因子15.1)、国际期刊Autophagy(中科院1区,最新影响因子13.3)发表系列论文,进一步阐明了心血管重构的分子机制。

流行病学研究显示,高血压是我国动脉粥样硬化性心血管病发生和发展的首要危险因素。在高血压的已知病理生理机制中,血管内皮功能异常是关键的起始因素,也是高血压大血管和微血管病变的前奏。血管紧张素转化酶(ACEI)类药物已成为治疗高血压的基石,传统观点认为,ACEI通过抑制血管紧张素II(AngII)的生成和抑制缓激肽的降解而发挥药理作用。齐鲁医院心血管内科张文程教授团队近期研究发现,ACEI通过内皮细胞中转录因子Sp1/Sp3发挥促血管新生的作用(Nat Commun.2023;14(1):731)。然而,ACEI是否改善血管内皮功能异常及其机制尚不明了。转录因子Sp1/Sp3在哺乳动物的各类细胞中广泛表达,Sp1/Sp3基因敲除小鼠均表现出心血管发育异常。该课题组发现,在高血压患者和AngII诱导的高血压小鼠模型的动脉内皮细胞中,Sp1/Sp3的表达量显著降低。因此,课题组构建了他莫昔芬诱导的内皮细胞特异性Sp1/Sp3基因双敲小鼠,发现从7周龄起,基因敲除小鼠的血压升高,肠系膜动脉的血管张力实验证实,基因敲除小鼠的内皮依赖性血管舒张功能显著下降,至40周龄时,基因敲除小鼠出现了显著的心脏肥大和心功能障碍。课题组通过深入研究,发现Sp1/Sp3可结合于AMPKα1和 AMPKα2的启动子区域并促进其转录。实验表明,Sp1/Sp3敲除导致AMPKα1和 AMPKα2表达降低,小窝蛋白Caveolin-1表达升高,从而结合eNOS并抑制其活性,导致血管内皮功能异常和高血压。其后,课题组利用ACEI类药物卡托普利治疗基因敲除小鼠,发现与对照组小鼠相比,在生理状态和AngII诱导的高血压模型中,卡托普利均无法改善Sp1/Sp3敲除所导致的高血压和血管内皮功能异常,说明Sp1/Sp3很可能介导了卡托普利的药理作用。体内和体外实验表明,卡托普利可不依赖于缓激肽而直接激活缓激肽B1受体,上调Sp1/Sp3表达。进一步研究发现,卡托普利通过HDAC1 使Sp1/Sp3去乙酰化并抑制其泛素化降解,从而导致下游通路激活。总之,本研究发现Sp1/Sp3通过调控AMPKα1/α2转录来维持正常血管内皮功能和血压稳定,阐明了卡托普利通过缓激肽B1受体上调Sp1/Sp3的分子机制,为治疗高血压和血管内皮功能异常提供了新的靶点,同时也为探索ACEI的药理学新机制提供了思路。该研究近日发表于Nature Communications,山东大学齐鲁医院心血管内科博士后吕翰林和普通外科姜秀新为论文共同第一作者,张文程教授为论文的通讯作者,山东大学齐鲁医院为论文的第一和通讯作者单位。

心脏重构是几乎所有心血管疾病的共同病理改变,可导致心功能异常,增加心力衰竭的发病率和死亡率。缺血性心脏病和心肌梗死(MI)所致的心力衰竭仍是全球的主要死因。在心脏细胞中,成纤维细胞(CFs)的数量最多,在细胞外基质(ECM)功能的调节中起重要作用。研究表明,在MI早期的炎症和坏死阶段,及时和适当限制炎症程度和持续时间可改善MI晚期增殖和纤维化阶段的心肌愈合质量。NF-κB抑制因子(NKRF)是由X染色体上的基因编码的转录抑制因子,在多种疾病中发挥了保护作用。然而,NKRF在心肌梗死后心脏重构发生发展以及心脏成纤维细胞功能调节中的作用和机制不明。齐鲁医院心血管内科张澄教授和张猛教授团队发现,在心肌梗死小鼠模型的梗死边缘区的CFs中,NKRF的表达显著减少。同样,在高血压小鼠模型纤维化心脏组织的CFs中,也发现NKRF表达明显降低。这提示,CFs中NKRF在病理性心脏重构中可能发挥重要作用。体外实验表明,炎症因子TNFα显著抑制CFs中NKRF的表达。为了明确CFs中NKRF在心肌梗死后心室重构中的作用,该课题组构建了CFs特异性NKRF基因敲除小鼠(NKRF-CKO),并给予NKRF-CKO和同窝对照小鼠(NKRFF/F)心肌梗死手术或假手术处理。结果显示,与NKRFF/F鼠相比,NKRF-CKO小鼠的左室内径、梗死面积、梗死边缘区MMP2和MMP9表达以及心重/体重比增大、左室功能和生存率降低。体外实验证实,NKRF显著抑制了TNFα诱导的MMP2和MMP9的表达以及CFs的迁移和侵袭。此外,RIP和mRNA半衰期实验证实,NKRF明显抑制了TNFα和MI诱导的mRNA稳定蛋白HuR的表达,进而抑制了MMP2和MMP9 mRNA的稳定性。为了进一步明确NKRF如何调控HuR的表达,课题组在HuR启动子区域发现了与NRE(negative regulatory element)有相似序列的一段碱基,通过删减NRE序列,利用双荧光素酶报告基因、CHIP、IF共定位及Co-IP技术,证明了NKRF通过NF-κB依赖性机制与HuR启动子NRE序列结合,从而抑制HuR的转录。体外实验表明,NKRF过表达可抑制MMP2和MMP9表达以及CFs的迁移和侵袭,而在过表达NKRF基础上进一步过表达HuR则可明显逆转NKRF的上述有益作用。体内实验发现,HuR敲低明显挽救了NKRF-CKO小鼠MI后恶化的左室内径和功能等上述测量指标。为了进一步探索NKRF在MI后左室重构中的潜在治疗作用,课题组在C57BL/6J小鼠尾静脉中注射了AAV-Nkrf,结果显示,NKRF过表达显著改善了MI后恶化的左室内径和功能等上述测量指标,而通过尾静脉注射AAV-HuR促使HuR过表达则显著逆转了NKRF对上述测量指标的改善。总之,该研究发现了NKRF在心肌梗死后左室重构中的重要作用和机制,为预防和治疗MI后心脏重构提供新的潜在治疗靶点。该研究发表于国际权威期刊Advanced Science,山东大学齐鲁医院心血管内科博士研究生郭成虎是论文的第一作者,张澄教授、张猛教授和孔静博士为论文的共同通讯作者。山东大学齐鲁医院为论文的第一和通讯作者单位。
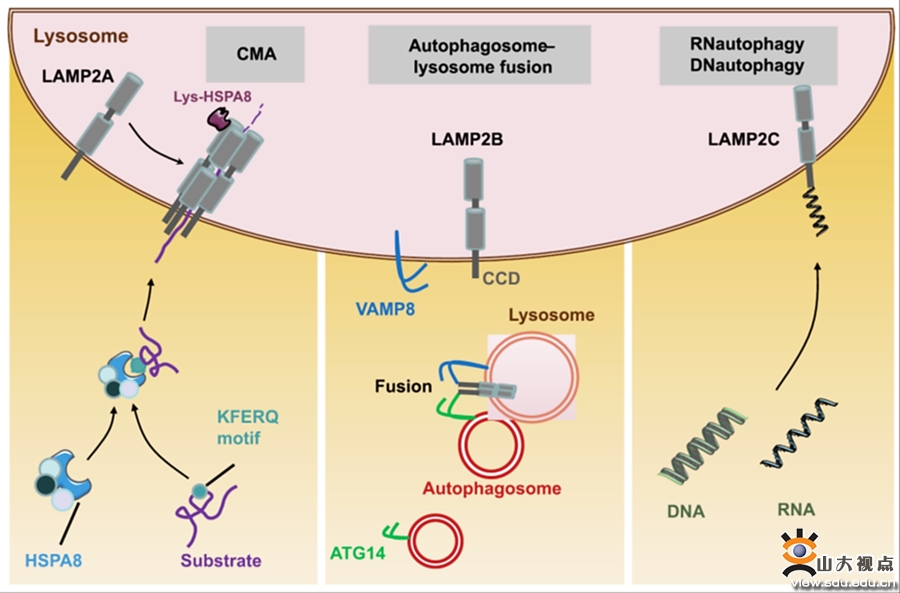
溶酶体(lysosome)是真核细胞发挥降解功能最主要的细胞器,可降解由内吞或自噬等途径输送到溶酶体的多种生物大分子和损伤的细胞器。此外,溶酶体在细胞的营养感知、信号转导、基因表达调控、细胞死亡、质膜修复、抗原加工和提呈以及细胞器质量控制等过程中发挥着重要作用。溶酶体的功能异常与多种疾病密切相关。溶酶体相关膜蛋白2(LAMP2)是溶酶体中含量丰富的一种膜蛋白,对溶酶体结构和功能的维持起到重要作用。Lamp2基因经选择性剪切后翻译可形成三种蛋白亚型:LAMP2A、LAMP2B和LAMP2C,三种亚型的结构和功能均不同,并分别参与了不同的病理生理过程。深入研究LAMP2及三种蛋白亚型的功能有助于揭示自噬—溶酶体系统与人类疾病的关系。近年来,齐鲁医院心血管内科陈文强教授、吕慧霞教授和张猛教授团队在自噬研究领域中取得了多项重要成果,论文发表在Circ Res、Autophagy、Theranostics、Cell Death Dis等著名期刊。在此基础上,该团队深入分析和系统总结了LAMP2的国内外研究,首次阐述了LAMP2A、LAMP2B和LAMP2C三种蛋白亚型的结构、分布和功能特点,分析了三种亚型在心血管疾病、衰老、神经退行性疾病、代谢性疾病、免疫性疾病和肿瘤等多种疾病发生和发展中的关键作用,提出了通过靶向LAMP2A防治心血管疾病的新策略,并展望了该领域未来的发展方向。作者根据最新的研究成果描绘了三种蛋白亚型在脊椎动物进化过程中的演变,提出了LAMP2A依赖的分子伴侣介导的自噬(CMA)出现在脊椎动物进化的早期,且为脊椎动物所特有的创新性观点。基于三种蛋白亚型氨基酸序列中的不同功能域,作者提出了未来需要探讨的研究方法学。该综述发表于自噬领域国际权威期刊Autophagy,山东大学齐鲁医院心血管内科医师乔磊、硕士研究生胡嘉怡和邱筱涵为该文章的共同第一作者,陈文强教授、吕慧霞教授和张猛教授为共同通讯作者。山东大学齐鲁医院为论文的第一和通讯作者单位。
原文链接:
1.Endothelial Sp1/Sp3 are essential to the effect of captopril on blood pressure in male mice
2.NKRF in Cardiac Fibroblasts Protects against Cardiac Remodeling Post-Myocardial Infarction via Human Antigen R
3.LAMP2A, LAMP2B and LAMP2C: similar structures, divergent roles
