[本站讯]近日,山东大学齐鲁医院神经外科倪石磊教授团队与山东大学药学院姜新义教授团队合作构建了一种免疫刺激性自裂解沙门氏菌-纳米胶囊输送系统,并成功应用于恶性脑胶质母细胞瘤动物模型的术后局部治疗。研究成果以“Stimulation of Tumoricidal Immunity via Bacteriotherapy Inhibits Glioblastoma Relapse”为题发表于Nature Communications。齐鲁医院神经外科张玉霖、研究生席开颜和博士研究生付志鹏为第一作者,倪石磊教授、姜新义教授和陈晨为本文通讯作者,山东大学为第一作者和唯一通讯作者单位。
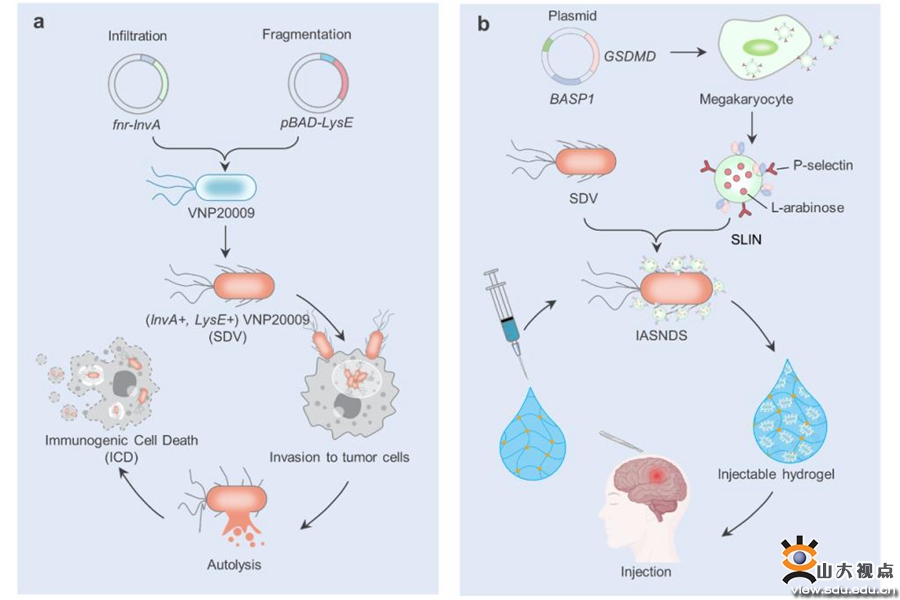
多形性胶质母细胞瘤(GBM)是神经外科最常见的颅内恶性肿瘤,其强侵袭性使得传统手术治疗难以彻底切除肿瘤组织,抑制性免疫微环境导致肿瘤极易局部复发。因此,开发新型的抗肿瘤免疫策略来追踪和根除术后残留的肿瘤细胞,对预防GBM术后复发至关重要。
先天性免疫和适应性免疫的协同作用可以增强机体对肿瘤的免疫应答,可用于对抗肿瘤细胞的增殖和扩散,提高治疗效果。研究发现特定细菌可以在肿瘤细胞内定植、增殖,经编辑后可释放药物,从而对肿瘤细胞产生直接或间接的杀伤作用。同时细菌表面或分泌的多种抗原可与机体的固有或适应性免疫相关受体结合,刺激机体免疫记忆的形成,抑制肿瘤复发。因此,研究团队提出,通过联合应用自裂解沙门氏菌载体和可注射的ATP响应水凝胶,有效募集免疫细胞到达肿瘤局部,逆转肿瘤局部的免疫抑制微环境,形成免疫记忆,最大程度抑制GBM术后复发。
本研究利用减毒鼠伤寒沙门氏菌(VNP20009)背包携带功能化外泌体开发了一种沙门氏菌自裂解体系(IASNDS),进入细胞后可响应性启动细菌裂解,释放细菌组分,引起抗肿瘤免疫反应,同时规避细菌感染风险。本研究利用ATP响应性水凝胶在GBM术后空腔内共递送免疫佐剂和IASNDS,IASNDS 可激活先天性免疫反应,协同 GBM 细胞焦亡释放的细菌成分和炎性因子重塑 GBM 免疫微环境,增强抗原递呈,持续激活适应性免疫反应,用于治疗GBM术后复发。本研究研发的细菌-凝胶递送系统为抑制GBM术后复发的临床难题提供一种可行的方案,未来可广泛适用于其他易复发且免疫浸润不良的恶性肿瘤。
该研究工作得到了国家自然科学基金、山东省自然科学基金、中国博士后科学基金、济南市科技局创新项目、山东省博士后创新人才计划和泰山学者等项目支持。
