[本站讯]近日,基础医学院教授马春红、副研究员武专昌作为共同通讯作者在Science immunology杂志在线发表了题为“Palmitoylation of TIM-3 promotes immune exhaustion and restrains anti-tumor immunity”的研究成果,揭示了TIM-3棕榈酰化在抗肿瘤免疫中的关键作用,为基于TIM-3检查点阻断的肿瘤免疫治疗提供了新策略。基础医学院博士研究生张召英为该论文的第一作者,山东大学作为论文的第一作者单位和通讯作者单位。

TIM-3是继PD-1/PD-L1、CTLA-4之后,又一个重要的新兴免疫检查点分子,其在多种免疫细胞上被发现,包括Th1细胞、CTL、单核细胞、巨噬细胞、NK细胞和树突状细胞,并被视作慢性病毒感染和癌症中T细胞终末耗竭的重要标志。TIM-3阻断的多种小鼠肿瘤治疗模型中显示了良好抗肿瘤作用,已经有多个靶向TIM-3的药物进入临床试验,但目前临床上TIM-3靶向的肿瘤免疫治疗获益仍然有限,TIM-3表达是如何调控的?其表达模式是否存在特殊之处?目前仍不是很清楚。
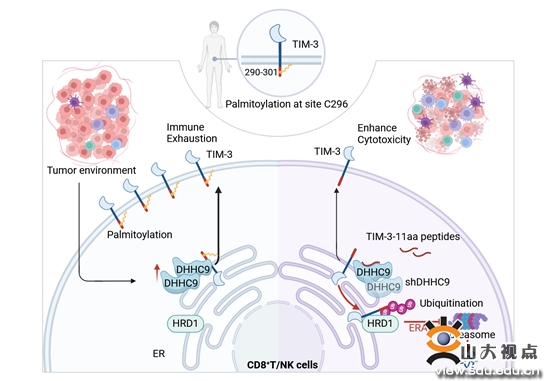
该文章发现灵长类动物TIM-3胞质结构域尾部存在特有的11个氨基酸(11aa),其296位点Cys (C296)存在棕榈酰化修饰,此修饰对TIM-3膜表达和蛋白稳定性至关重要。棕榈酰化缺失导致TIM-3被内质网中E3泛素连接酶HRD1识别和K48连接的多聚泛素化修饰,经ER相关蛋白降解途径(ERAD)降解。进一步筛选发现DHHC9是调控TIM-3蛋白棕榈酰化修饰和稳定表达的关键酶,其在肝癌浸润CD8+T和NK细胞上高表达,并与TIM-3的高表达和肝癌患者的不良预后密切相关。在靶细胞反复刺激诱导T细胞耗竭模型中,证实DHHC9调控的TIM-3棕榈酰化修饰是TIM-3介导免疫效应细胞耗竭的重要原因。设计开发的TIM-3棕榈酰化阻断多肽,可特异性抑制DHHC9结合和修饰TIM-3,并显著提高CAR-T细胞和NK细胞的抗肿瘤功能。此研究结果揭示了之前未知的TIM-3棕榈酰化机制及其在决定TIM-3蛋白命运中的关键作用,为靶向TIM-3翻译后修饰的肿瘤免疫疗法提供了一种新策略。
马春红教授团队长期致力于肝脏免疫微环境调控和干预策略研究,系统探索HBV、代谢等环境因素诱发肝脏炎症及其恶性转化机制,为HBV以及肿瘤免疫治疗提供了潜在靶点和新思路。相关成果相继发表在Sci Immunol、Sci Transl Med、J Hepatol、Nat Commun、J Exp Med、Gastroenterology、Gut、Hepatology等国际学术期刊。工作得到了国家重点研发计划、国家自然科学基金重点项目及泰山攀登计划等项目资助。
