
[本站讯]近日,国家糖工程技术研究中心肖敏课题组蒋绪恺团队在膜脂质调控膜蛋白功能的分子机制方面取得重要进展,相关研究成果以“Membrane lipid homeostasis dually regulates conformational transition of phosphoethanolamine transferase EptA”为题发表在Nature Communications期刊。山东大学强基计划生物方向研究生马振宇为论文第一作者,山东大学副研究员蒋绪恺、莫纳什大学教授李健为论文通讯作者,山东大学为第一完成单位和通讯作者单位。
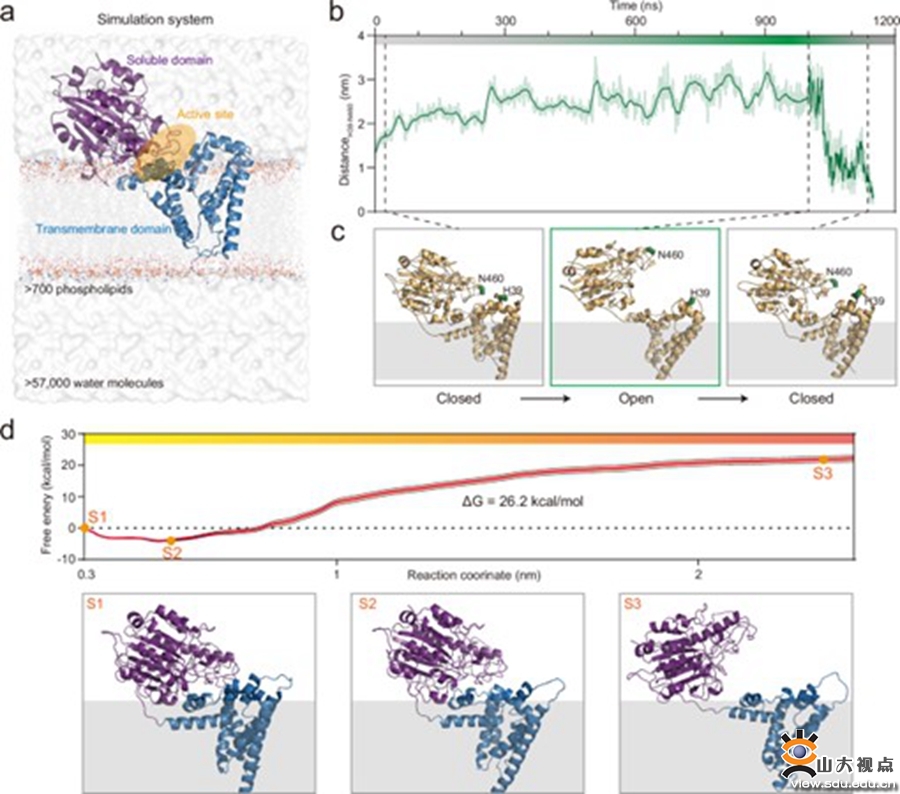
多重耐药的革兰氏阴性菌已成为全球性的公共健康危机。革兰氏阴性菌的外膜主要由脂多糖(LPS)、磷脂和膜蛋白组成,作为重要的保护屏障,帮助细菌抵御外界环境的挑战。在多种酶的催化下,阳离子基团(如磷酸乙醇胺[pEtN]、4-氨基-4-脱氧-L-阿拉伯糖和半乳糖胺)可被修饰到LPS的磷酸基团上,以增强细菌外膜的屏障功能,导致细菌抗生素耐药。EptA是革兰氏阴性菌中最重要的LPS修饰酶之一,它以细菌细胞膜中的磷脂酰乙醇胺(PE)作为修饰基团供体,以Re LPS作为修饰基团受体,介导LPS发生pEtN修饰,导致抗生素耐药性。值得注意的是,质粒携带的mcr-1基因编码的蛋白与EptA具有高度同源性。mcr-1基因在多种细菌间的水平基因转移大大增加了LPS-pEtN修饰的影响,加剧了细菌耐药。
本研究通过微秒级的全原子分子动力学模拟,重建了EptA从关闭构象到开放构象的动态循环过程,发现PE和Re LPS通过不同的路径进入EptA的底物结合口袋。结合虚拟突变和进化动力学分析,发现EptA结构域界面的相互作用是动态的,并受到底物PE结合的调节。特别是可溶结构域与细胞膜的相互作用被发现是维持开放构象的关键因素。同时,EptA催化引起的局部脂质环境变化影响了EptA与细胞膜之间的相互作用,从而调控了两种构象之间的转变。总之,EptA的构象动态与催化功能受膜脂质微环境的调控,尤其是PE脂质的局部浓度,本研究提出了一种受脂质微环境影响的膜蛋白自我调控模型,并为细菌耐药性与生存之间的平衡提供了新的见解。
本研究得到了科技部重点研发计划、国家自然科学基金、山东省海外优青等项目的资助。蒋绪恺团队长期致力于细胞膜系统的计算生物物理和人工智能研究,系列成果发表在Nature Communications、Advanced Science、Chemical Science、Journal of Medicinal Chemistry等学术期刊。
